
23/10/2025 15:25
Chuyển đổi Na2SO3 thành Na2SO4 qua phản ứng với H2SO4
Phản ứng giữa Natri sunfit (Na2SO3) và Axit sunfuric (H2SO4) là một trong những phản ứng quan trọng trong hóa học, đặc biệt trong ngành hóa chất. Phản ứng này không chỉ giúp điều chế muối natri sunfat (Na2SO4) mà còn tạo ra khí lưu huỳnh điôxit (SO2), một hợp chất có nhiều ứng dụng trong công nghiệp. Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về phản ứng này, các điều kiện cần thiết và ý nghĩa của nó trong thực tiễn.

1. Phương trình phản ứng hóa học
Phương trình phản ứng giữa Na2SO3 và H2SO4 được thể hiện như sau: Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O Phương trình này cho thấy rằng khi Natri sunfit tác dụng với Axit sunfuric, chúng sẽ tạo ra Natri sunfat, khí SO2 và nước.2. Điều kiện phản ứng
2.1 Nhiệt độ
Phản ứng này diễn ra ở nhiệt độ thường, không yêu cầu điều kiện nhiệt độ cao, điều này làm cho nó dễ thực hiện trong phòng thí nghiệm cũng như trong sản xuất công nghiệp.2.2 Tỉ lệ phản ứng
Khi thực hiện phản ứng, tỉ lệ mol giữa Na2SO3 và H2SO4 cần phải đạt chuẩn để đảm bảo phản ứng diễn ra hoàn toàn và hiệu quả. Tỉ lệ lý tưởng là 1:1.3. Bản chất của các chất tham gia phản ứng
3.1 Na2SO3 (Natri sunfit)
Natri sunfit là một hợp chất hóa học được sử dụng rộng rãi trong công nghiệp và phòng thí nghiệm. Khi tiếp xúc với axit mạnh như H2SO4, Na2SO3 sẽ trải qua quá trình phân hủy, giải phóng khí SO2 có mùi hắc.3.2 H2SO4 (Axit sunfuric)
H2SO4 là một axit mạnh, có khả năng tác dụng với các muối và các hợp chất khác. Nó thường được sử dụng trong nhiều phản ứng hóa học để tạo ra các sản phẩm khác nhau. Axit này không chỉ có tính axit mạnh mà còn là chất oxi hóa mạnh.4. Cách tiến hành điều chế SO2 trong phòng thí nghiệm
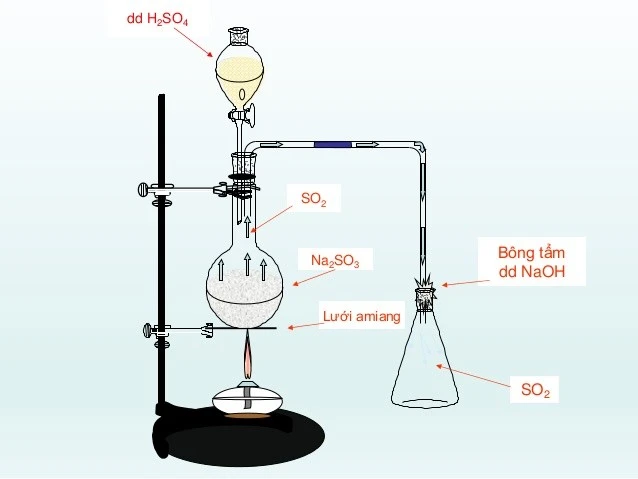
Để điều chế SO2 trong phòng thí nghiệm, ta có thể thực hiện theo các bước sau đây:- Chuẩn bị dụng cụ: Dụng cụ cần thiết bao gồm ống nghiệm, bông tẩm dung dịch NaOH, một ống dẫn khí và một bình chứa.
- Chuẩn bị phản ứng: Cho Na2SO3 vào ống nghiệm và thêm H2SO4 vào từ từ.
- Tiến hành thu khí: Khí SO2 được sinh ra sẽ được thu qua ống dẫn khí và không khí trong ống nghiệm sẽ được chuyển ra ngoài.
- Sử dụng bông tẩm dung dịch NaOH: Để hạn chế lượng khí SO2 thoát ra ngoài, bông tẩm dung dịch NaOH sẽ hấp thụ phần lớn khí SO2.
5. Hiện tượng nhận biết phản ứng điều chế lưu huỳnh điôxit
Khi phản ứng diễn ra, người ta sẽ thấy có khí không màu và có mùi hắc thoát ra. Đây chính là khí SO2. Việc thu khí SO2 bằng phương pháp chuyển không khí sẽ dễ dàng hơn khi sử dụng bông tẩm dung dịch NaOH. Ngược lại, nếu dùng bông tẩm dung dịch amoniac NH3 sẽ không hiệu quả do NH3 là khí dễ bay hơi.6. Tính chất hoá học của H2SO4
6.1 H2SO4 loãng
Axit sunfuric loãng thể hiện đầy đủ tính chất hóa học chung của axit. Cụ thể:- H2SO4 làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với kim loại (trừ chì) để tạo thành muối sunfat.
- Tác dụng với oxit bazơ để tạo ra muối và nước.
- Tác dụng với bazơ để tạo ra muối mới và nước.
6.2 H2SO4 đặc
H2SO4 đặc là một chất vừa có tính axit mạnh, vừa có tính oxi hóa mạnh. Nó có thể:- Tác dụng với kim loại tạo ra muối và khí SO2.
- Tác dụng với các phi kim thời điểm nhất định để tạo thành oxit phi kim và khí SO2.
- H2SO4 cũng có tính háo nước, thể hiện rõ qua phản ứng với đường, tạo ra mùi khét và đen.
7. Ứng dụng của H2SO4
Axit sunfuric có vai trò rất quan trọng trong:- Sản xuất phân bón: H2SO4 được sử dụng để sản xuất axit photphoric và amoni sunfat, hai thành phần cần thiết cho nhiều loại phân bón.
- Sản xuất công nghiệp: H2SO4 còn được dùng trong sản xuất kim loại, làm sạch bề mặt thép, sản xuất nhôm sunfat và nhiều sản phẩm khác.
- Xử lý nước thải: Đặc biệt, H2SO4 được ứng dụng để cải thiện nước và lọc tạp chất.
- Phòng thí nghiệm: Là hợp chất quan trọng để điều chế nhiều axit khác.
8. Bài tập vận dụng
Câu 1:
Khi làm thí nghiệm với H2SO4 đặc, khí SO2 thoát ra nhiều. Để hạn chế sự ô nhiễm, người ta dùng bông tẩm dung dịch nào? Đáp án: C (Xút) Giải thích: Xút có khả năng phản ứng với SO2 để tạo thành hợp chất không bay hơi, hạn chế sự thoát khí SO2 ra môi trường.Câu 2:
Dãy chất nào tác dụng với khí SO2? Đáp án: B (KOH, CaO, H2O)Câu 3:
Hòa tan V lít khí SO2 vào 100 ml dung dịch NaOH 1,2M, thu được 10,02g hỗn hợp hai muối. Tìm giá trị của V? Đáp án: A (2,016 lít)Câu 4:
SO2 gây ô nhiễm môi trường do nguyên nhân nào? Đáp án: C (Khí độc, tan trong nước tạo thành axit)Kết luận
Phản ứng giữa Na2SO3 và H2SO4 không chỉ là một phản ứng hóa học đơn giản mà còn mở ra nhiều ứng dụng hữu ích trong đời sống. Từ điều chế Na2SO4 đến sản xuất SO2, những phản ứng này góp phần quan trọng trong ngành công nghiệp hóa chất. Hi vọng bài viết này sẽ giúp bạn hiểu rõ hơn về phản ứng hóa học thú vị này!
Link nội dung: https://www.iir.edu.vn/chuyen-doi-na2so3-thanh-na2so4-qua-phan-ung-voi-h2so4-a12512.html