
21/10/2025 18:50
Phân Tích Phản Ứng CO và Fe3O4 Trong Sản Xuất Thép

Giới thiệu
Trong hóa học, phản ứng giữa Sắt(III) Oxit (Fe₂O₃) và Cacbon Monoxit (CO) không chỉ là một phản ứng oxy hóa-khử đơn thuần mà còn đóng vai trò quan trọng trong quy trình sản xuất vật liệu sắt và thép. Qua bài viết này, chúng ta sẽ cùng khám phá chi tiết phương trình phản ứng, điều kiện thực hiện, nguyên lý hóa học, cách tiến hành và những ứng dụng thực tiễn liên quan đến sản phẩm của phản ứng này.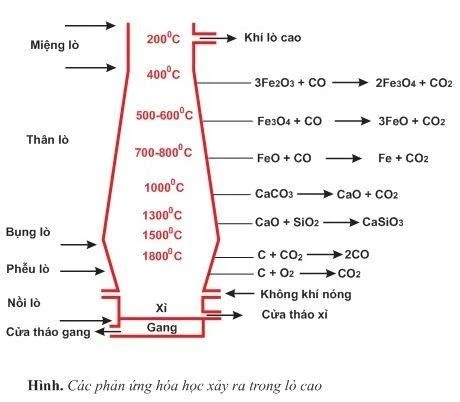
Phương Trình Hóa Học
Phương trình chưa cân bằng
\[ F{e_3}{O_4} + CO \mathop \to \limits^{t \circ } FeO + C{O_2} \uparrow \]Phương trình đã cân bằng
\[ F{e_3}{O_4} + CO \mathop \to \limits^{t^\circ } 3FeO + C{O_2} \uparrow \]Điều Kiện Phản Ứng
Nhiệt độ
Phản ứng xảy ra trong điều kiện nhiệt độ cao, thường ở khoảng 500 - 600 độ C. Đây là điều kiện tối ưu cho việc khử Sắt(III) Oxit thành Sắt(II,III) Oxit (Fe₃O₄) và khí Cacbon Dioxit.Nguyên Lý Phản Ứng
Oxi Hóa - Khử
Trong phản ứng này:- Fe₂O₃: Chứa ion Fe³⁺, ion này được khử một phần thành trạng thái hỗn hợp Fe²⁺ và Fe³⁺ trong Fe₃O₄.
- CO: Là chất khử, có C²⁺ bị oxi hóa thành C⁴⁺ trong CO₂.
- Sản phẩm: Là Fe₃O₄ (chất rắn) và CO₂ (khí).
Phương Trình Electron
- Quá trình khử:
- Quá trình oxi hóa:
Tổng quát
\[ F{e_3}{O_4} + CO \mathop \to \limits^{t^\circ } 3FeO + C{O_2} \uparrow \]Cách Thực Hiện Phản Ứng
Chuẩn Bị
Vật Liệu
- Oxit Sắt (Fe₃O₄) dạng bột.
- Khí Cacbon Monoxit: Có thể được tạo ra từ than cốc hoặc từ bình khí nén.
Dụng Cụ
- Lò nung nhiệt độ cao.
- Ống dẫn khí CO.
- Khay chịu nhiệt.
Thiết Bị Hỗ Trợ
- Hệ thống thông gió hoặc tủ hút để xử lý CO và CO₂.
- Thiết bị đo nhiệt độ.
Trình Tự Tiến Hành
- Cho một lượng Fe₃O₄ (khoảng 10-20 g) vào khay chịu nhiệt hoặc lò nung.
- Đặt khay vào lò, điều chỉnh nhiệt độ lên khoảng 500 - 600°C.
- Dẫn khí CO vào lò với tốc độ ổn định, đảm bảo môi trường khử (ít oxy).
- Quan sát hiện tượng: Có khí CO₂ thoát ra (thử bằng nước vôi trong, tạo kết tủa CaCO₃).
- Sau phản ứng (khoảng 30-60 phút tùy quy mô), làm nguội lò, thu lấy FeO và kiểm tra CO₂.
Lưu ý
- CO là khí độc, cần chuẩn bị tủ hút hoặc hệ thống thông gió để tránh hít phải.
- Nhiệt độ cao gây nguy hiểm, cần trang bị thiết bị bảo hộ và lò nung chuyên dụng.
- Kiểm soát nhiệt độ để tránh khử sâu thành Fe.
Nhận Biết Phản Ứng
Hiện Tượng Quan Sát Được
- Có khí không màu (CO₂) thoát ra, không có mùi, khó nhận biết trực quan.
Kiểm Chứng Sản Phẩm
- FeO có màu đen, có thể gây nổ vì dễ bốc cháy.
- Thử tính chất: FeO có tính từ mạnh (hút nam châm), trong khi Fe₂O₃ không có hoặc rất yếu.
Dẫn Khí Thoát Ra Qua Dung Dịch Nước Vôi Trong
Nếu xuất hiện kết tủa trắng (CaCO₃), đó là dấu hiệu của CO₂.Kiến Thức Mở Rộng Về Quá Trình Phản Ứng
Quá Trình Luyện Gang Trong Lò Cao
Quá trình luyện gang trong lò cao là một ví dụ điển hình cho ứng dụng của phản ứng này trong sản xuất kim loại. Quá trình chuyển hóa quặng sắt thành sắt kim loại không diễn ra đơn lẻ mà thông qua nhiều bước trung gian, dưới tác động quyết định của nhiệt độ và các chất khử như CO, C và đôi khi là H₂.Phân Tích Quá Trình Phản Ứng Trong Lò Cao và Vai Trò Của Nhiệt Độ
Trong lò cao, quặng sắt (Fe₂O₃) được khử thành sắt nguyên tố theo ba nấc phản ứng chính. Mỗi nấc tương ứng với từng vùng nhiệt độ nhất định, từ thấp đến cao:- Nhiệt độ 200-400°C: Khí chủ yếu là CO, CO₂, và N₂. Fe₂O₃ bắt đầu tiếp xúc với CO, nhưng không đủ năng lượng để khử hoàn toàn.
- Nhiệt độ 400-600°C: Phản ứng khử đầu tiên xảy ra, CO hoạt động như một chất khử, tạo ra Fe₃O₄.
- Nhiệt độ 600-800°C: FeO bị khử tiếp xuống Fe nguyên tố.
Cấu Trúc Tinh Thể Của Fe₂O₃ Và FeO
Cấu Trúc và Tính Chất Của Fe₂O₃ (Hematit)
- Có cấu trúc lục phương và bền bỉ nhờ các liên kết ion mạnh.
- Khó khử ở nhiệt độ thấp, cần nhiệt độ cao để kích hoạt phản ứng.
Cấu Trúc và Tính Chất Của FeO (Wustit)
- Có cấu trúc lập phương kiểu NaCl.
- Liên kết ion kém bền hơn, dễ dàng phản ứng hóa học diễn ra.
Ảnh Hưởng Tới Quá Trình Khử
Việc chuyển hóa từ Fe₂O₃ sang FeO không chỉ là sự trao đổi electron mà còn liên quan tới sự tái cấu trúc mạng tinh thể.So Sánh CO với Các Chất Khử Khác: H₂ và C
Cơ Chế Phản Ứng Khử
- CO: Nhường electron cho Fe³⁺ và sinh ra CO₂.
- H₂: Phá vỡ liên kết oxi và tạo ra nước (H₂O).
- C: Khử oxit kim loại qua hình thức nhường electron hoặc tạo CO, và sau đó CO hoạt động như chất khử.
Độ Mạnh Tính Khử
- H₂ mạnh hơn CO ở nhiệt độ thấp nhưng ngược lại khi nhiệt độ tăng lên.
- C chỉ hoạt động mạnh ở nhiệt độ rất cao.
Ảnh Hưởng Của Nhiệt Độ, Xúc Tác Và Môi Trường
- Nhiệt độ cao làm tăng tính khử của CO và C.
- Xúc tác tại bề mặt có thể gia tăng tốc độ phản ứng.
- Môi trường giàu CO sẽ làm tăng cường phản ứng khử của CO.
Ứng Dụng
Luyện Kim
Phản ứng giữa Fe₂O₃ và CO là bước đầu trong quy trình sản xuất sắt thép.Ứng Dụng Của Fe₃O₄
- Sản xuất vật liệu từ tính, xúc tác, và xử lý nước thải.
Ứng Dụng Của CO
- Sử dụng để khử quặng kim loại và trong tổng hợp hóa học.
Ứng Dụng Của CO₂
- Sản xuất nước giải khát và ứng dụng trong dập lửa.
Môi Trường
Fe₃O₄ có tiềm năng trong xử lý nước thải nhưng cần quản lý việc phát sinh CO và CO₂.Bài Tập Vận Dụng
Đề Bài
Nung nóng 20,32 gam hỗn hợp gồm Fe₃O₄ và Fe₂O₃ trong dòng khí CO dư ở nhiệt độ 500 độ C. Phản ứng xảy ra hoàn toàn thu được 18,72 gram chất rắn X. Tính:- a) Phương trình phản ứng.
- b) Khối lượng Fe₃O₄ và Fe₂O₃ ban đầu.
- c) Thể tích khí CO đã phản ứng.
- d) Thể tích dung dịch HCl cần để hòa tan hoàn toàn X.
Giải
- Phương trình hóa học:
- Tính khối lượng:
- Thể tích khí CO (đktc):
- Thể tích dung dịch HCl cần thiết:
Kết Luận
Phản ứng giữa Sắt(III) Oxit và Cacbon Monoxit là một trong những phản ứng quan trọng trong hóa học, không chỉ tác động trực tiếp đến quá trình sản xuất sắt thép mà còn mở ra nhiều ứng dụng trong công nghiệp hóa học và bảo vệ môi trường. Việc hiểu rõ cơ chế phản ứng, điều kiện thực hiện và các ứng dụng của chúng sẽ giúp chúng ta có cái nhìn tổng quát hơn về ngành luyện kim và hóa học vô cơ.
Link nội dung: https://www.iir.edu.vn/phan-tich-phan-ung-co-va-fe3o4-trong-san-xuat-thep-a12240.html