
21/10/2025 13:15
Phản ứng NH4Cl ra NH3: Cách thức và điều kiện

Giới thiệu về NH4Cl và phản ứng nhiệt phân
Amoni clorua (NH4Cl) là một hợp chất hóa học quan trọng thường được sử dụng trong ngành hóa học cũng như trong nhiều lĩnh vực khác nhau. Một trong những phản ứng quan trọng của NH4Cl chính là phản ứng nhiệt phân để tạo ra khí amoniac (NH3). Trong bài viết này, chúng ta sẽ tìm hiểu chi tiết về phương trình phản ứng NH4Cl ra NH3, điều kiện phản ứng, và các ứng dụng thực tiễn của nó.
Amoni clorua (NH4Cl) là chất gì?
NH4Cl, hay còn gọi là muối amoni, là một hợp chất vô cơ có công thức phân tử NH4Cl. Chất này thường xuất hiện dưới dạng tinh thể màu trắng, hút ẩm cao và dễ tan trong nước. NH4Cl không chỉ là nguyên liệu trong hóa học, mà còn có nhiều ứng dụng trong ngàng công nghiệp và đời sống hàng ngày.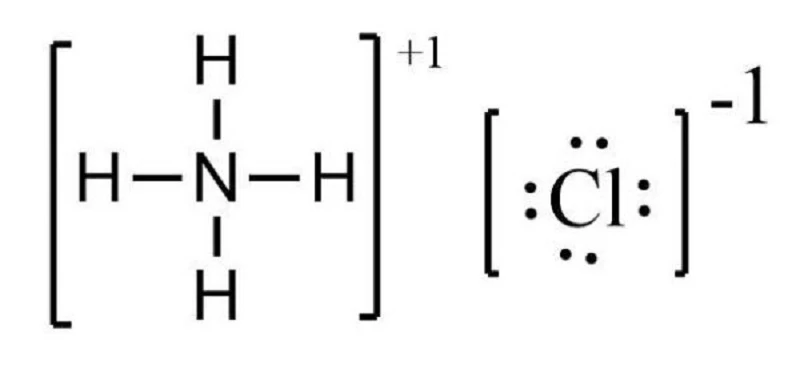
Tính chất của NH4Cl
- Hình dạng: Tinh thể màu trắng.
- Tan trong nước: Dễ dàng hòa tan trong nước, tạo thành dung dịch axit nhẹ.
- Nhiệt độ nóng chảy: Khoảng 338°C.
Phương trình phản ứng nhiệt phân NH4Cl ra NH3
Trong điều kiện nhiệt độ thích hợp, NH4Cl có thể phân hủy thành hai sản phẩm chính là amoniac (NH3) và axit clohidric (HCl). Phương trình hóa học cho phản ứng này được trình bày dưới đây:
Phương trình hóa học
Phản ứng nhiệt phân: ``` NH4Cl → NH3 + HCl (t°) ```
Giải thích phản ứng
- NH4Cl: Là hợp chất amoni clorua.
- NH3: Là khí amoniac, có mùi khai nồng, nhẹ hơn không khí và dễ tan trong nước.
- HCl: Là khí axit clohidric, có mùi hắc, nặng hơn không khí và tan tốt trong nước.
- Bước 1: Năng lượng nhiệt làm cho các liên kết trong phân tử NH4Cl rung động mạnh hơn. Khi nhiệt độ đủ cao, các liên kết sẽ bị phá vỡ, tạo thành ion NH4+ và Cl-.
- Bước 2: Các ion NH4+ kết hợp với nhau theo tỷ lệ mol 1:1 để tạo thành NH3 và HCl.

Quan sát thực nghiệm
Khi thực hiện thí nghiệm nhiệt phân NH4Cl trong ống nghiệm, bạn sẽ thấy:- Tinh thể NH4Cl dần dần biến mất.
- Khí NH3 không màu thoát ra với mùi khai nồng.
- Khí HCl không màu ngưng tụ trên thành ống nghiệm tạo ra giọt nước.
Ứng dụng của phản ứng nhiệt phân NH4Cl
Phản ứng nhiệt phân NH4Cl ra NH3 có ứng dụng rộng rãi trong công nghiệp, bao gồm:Sản xuất amoniac
Amoniac là một hóa chất quan trọng được sử dụng trong sản xuất phân bón, thuốc nổ và nhiều sản phẩm hóa học khác.Luyện kim
Amoniac được sử dụng để khử oxy trong quặng kim loại, giúp thu được kim loại tinh khiết hơn.Xử lý nước thải
Amoniac có vai trò trong việc khử trùng nước thải, góp phần vào công tác bảo vệ môi trường.Phương trình NH4Cl phản ứng với bazơ mạnh
Amoni clorua (NH4Cl) không chỉ có thể phân hủy dưới tác dụng của nhiệt mà còn phản ứng với bazơ mạnh, đặc biệt là natri hydroxide (NaOH), để giải phóng khí amoniac.Phương trình hóa học
Phản ứng với NaOH: ``` NH4Cl + NaOH → NH3 + H2O + NaCl ``` Phương trình ion rút gọn: ``` NH4+ + OH- → NH3 + H2O ```Giải thích phản ứng
Phản ứng này xảy ra do sự thay thế ion hidroxit (OH-) của bazơ NaOH vào nhóm amoni (NH4+). Điều này dẫn đến việc NH4Cl phân hủy thành NH3, H2O và NaCl. Khi phản ứng này diễn ra, bạn sẽ thấy bọt khí thoát ra với mùi khai nồng nặc từ khí NH3.Tính chất vật lý và hóa học của muối amoni
Tính chất vật lý
Muối amoni là một chất kết tinh ion, bao gồm cation amoni NH4+ và anion gốc axit. Các muối amoni đều hòa tan tốt trong nước và tạo thành các ion khi điện li hoàn toàn. Ví dụ: ``` (NH4) n A → n NH4 (+) + A n (-) NH4 (+) + H2O → NH3 + H3O (+) ```Tính chất hóa học
- Phản ứng thủy phân: Tạo ra môi trường axit.
- Tác dụng với dung dịch kiềm: Tạo ra khí amoniac.
- Phản ứng nhiệt phân: Phân hủy thành NH3 ở nhiệt độ cao.
Amoni Clorua sản xuất như thế nào?
Amoni clorua có thể được sản xuất qua hai phương pháp chính:Phương pháp phản ứng trung hòa
- Nguyên liệu: Amoniac (NH3) và axit clohidric (HCl).
- Phương trình phản ứng: NH3 + HCl → NH4Cl.
Quy trình sản xuất
- Amoniac dạng khí hòa tan trong nước để tạo dung dịch.
- Trộn dung dịch amoniac với dung dịch axit clohidric.
- Phản ứng xảy ra tạo dung dịch amoni clorua.
- Cô đặc và làm lạnh để kết tinh amoni clorua.
- Lọc, rửa và sấy khô amoni clorua.
Công nghệ Solvay
Phương pháp sản xuất amoni clorua kết hợp với soda (Na2CO3). Phương trình phản ứng: ``` CO2 + NH3 + 2NaCl + H2O → 2 NH4Cl + Na2CO3 ```Lưu ý cần thiết khi sử dụng và bảo quản NH4Cl
Bảo đảm an toàn khi sử dụng
- Đeo găng tay, kính bảo hộ và khẩu trang khi làm việc với NH4Cl.
- Tránh tiếp xúc với da, mắt và hô hấp.
Bảo quản
- Lưu trữ NH4Cl trong container kín, làm từ vật liệu không phản ứng.
- Để ở nơi khô ráo, thoáng mát, xa tầm tay trẻ em.
- Tránh ánh sáng mặt trời và nhiệt độ cao.
Kết luận
Phương trình nhiệt phân NH4Cl ra NH3 sẽ được thể hiện như sau: NH4Cl → NH3 + HCl(t°). Khi NH4Cl bị đun nóng, tinh thể này sẽ phân hủy thành khí NH3 và HCl. Việc hiểu rõ hơn về phản ứng này không chỉ giúp chúng ta trong học tập mà còn trong ứng dụng thực tiễn trong nhiều ngành nghề. Hãy tiếp tục theo dõi để khám phá thêm nhiều thông tin thú vị khác nhé!
Link nội dung: https://www.iir.edu.vn/phan-ung-nh4cl-ra-nh3-cach-thuc-va-dieu-kien-a12203.html