Phản ứng giữa hiđroxit sắt(II) (Fe(OH)₂) và oxy trong môi trường nước dẫn đến sự hình thành hiđroxit sắt(III) (Fe(OH)₃) là một trong những phản ứng hóa học quan trọng, đặc biệt trong lĩnh vực hóa học vô cơ và ứng dụng xử lý nước. Bài viết này sẽ khám phá phương trình hóa học, nguyên lý phản ứng, điều kiện cần thiết, và ứng dụng thực tiễn của phản ứng này.

Phương Trình Hóa Học
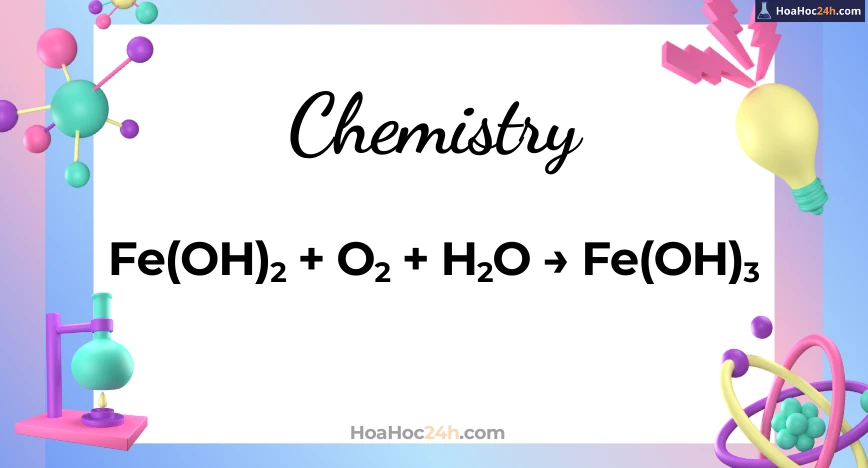
Phương Trình chưa Cân Bằng
Phản ứng giữa Fe(OH)₂, O₂ và H₂O có thể được biểu diễn qua phương trình:
\[
Fe(OH)_2 + O_2 + H_2O \to Fe(OH)_3
\]
Phương Trình Đã Cân Bằng
Phương trình đã được cân bằng sẽ là:
\[
2Fe(OH)_2 + \frac{1}{2}O_2 + H_2O \to 2Fe(OH)_3
\]
Điều Kiện Phản Ứng
Phản ứng này xảy ra dưới điều kiện thường, không cần xúc tác hoặc đun nóng. Oxy trong không khí đóng vai trò là chất oxy hóa, và môi trường nước giúp quá trình phản ứng diễn ra hiệu quả hơn.
Nguyên Lý Phản Ứng
1. Nguyên lý phản ứng
Quá trình oxy hóa Fe²⁺ thành Fe³⁺ thông qua sự hiện diện của O₂ và H₂O được giải thích như sau:
- Fe(OH)₂ chứa ion Fe²⁺.
- O₂ đóng vai trò là chất oxy hóa, chuyển Fe²⁺ thành Fe³⁺.
- Ion Fe³⁺ vừa hình thành sẽ tạo kết tủa hiđroxit sắt(III) Fe(OH)₃.
2. Phương Trình Ion Rút Gọn
Phương Trình Electron:
\[
Fe(OH)_2 \to Fe(OH)_2^- + e
\]
\[
\frac{1}{2}O_2 + H_2O + 2e \to 2OH^-
\]
Tổng quát:
\[
2Fe(OH)_2 + \frac{1}{2}O_2 + H_2O \to 2Fe(OH)_3
\]
Cách Thực Hiện Phản Ứng
1. Chuẩn Bị Hóa Chất
- Dung dịch muối sắt(II) (FeSO₄ hoặc FeCl₂)
- Dung dịch NaOH hoặc KOH loãng
- Nước cất
- Không khí hoặc oxy
- Dụng cụ: ống nghiệm, đũa thủy tinh, pipet, giá đỡ
2. Trình Tự Tiến Hành
- Pha dung dịch Fe²⁺ loãng (ví dụ: FeSO₄ 0.1M).
- Thêm từ từ dung dịch NaOH vào dung dịch cho đến dư để tạo kết tủa trắng xanh của Fe(OH)₂:
\[
Fe^{2+} + 2OH^- \to Fe(OH)_2 \downarrow
\]
- Để dung dịch tiếp xúc với không khí (hoặc sục O₂).
- Quan sát hiện tượng chuyển màu từ kết tủa trắng xanh sang nâu đỏ, đặc trưng của Fe(OH)₃.
3. Lưu Ý
- Dung dịch Fe²⁺ cần chuẩn bị mới để tránh bị oxy hóa trước đó.
- Phản ứng nên được thực hiện ngay sau khi tạo kết tủa Fe(OH)₂ để đảm bảo hiệu quả.
- Không sử dụng bình chứa kim loại vì có thể ảnh hưởng đến quá trình oxy hóa.
Nhận Biết Phản Ứng
Hiện Tượng Quan Sát
- Ban đầu: Kết tủa trắng xanh của Fe(OH)₂ hình thành.
- Sau vài phút tiếp xúc không khí: Kết tủa chuyển dần sang màu nâu đỏ, đặc trưng cho Fe(OH)₃.
Phương Pháp Nhận Biết Sản Phẩm
- Quan sát màu sắc: Fe(OH)₃ có màu nâu đỏ đặc trưng, không tan trong nước.
- Lọc tách kết tủa, rửa sạch và kiểm tra tính tan trong axit loãng: Fe(OH)₃ tan tạo muối Fe³⁺.
Kiến Thức Chuyên Sâu: Cơ Chế Hoạt Hóa Phân Tử O₂ và Hình Thành Fe(OH)₃
Hoạt Hóa Phân Tử Oxy (O₂)
Cấu Trúc Phân Tử O₂
Oxy phân tử có cấu trúc bền vững, tồn tại ở trạng thái triplet (có 2 electron độc thân ở orbital π*). Vì vậy, O₂ không dễ phản ứng trực tiếp với các ion hay phân tử ở trạng thái singlet.
Trong môi trường nước, O₂ có thể bị "hoạt hóa" thông qua các quá trình như:
- Tương tác với nước và ion kim loại (Fe²⁺ trong trường hợp này).
- Tạo thành các gốc tự do hoặc dạng trung gian phản ứng như superoxide (O₂⁻) hoặc hydroperoxide (HO₂•).
Tương Tác Giữa O₂•, Nước Và Fe²⁺
Phản Ứng Tạo H₂O₂ Và OH⁻
Các gốc O₂⁻ • tiếp tục phản ứng với proton (H⁺ từ nước) để tạo ra gốc hydroperoxyl (HO₂•):
\[
H_2O \to H^+ + OH^-
\]
\[
O_2^- + H^+ \to HO_2\cdot
\]
Hai gốc HO₂• có thể kết hợp để tạo thành H₂O₂:
\[
2HO_2\cdot \to H_2O_2 + O_2
\]
Hình Thành Fe(OH)₃
Ion Fe³⁺ sinh ra từ quá trình oxy hóa sẽ phản ứng ngay lập tức với OH⁻ trong dung dịch, dẫn đến sự hình thành kết tủa:
\[
Fe(OH)_2^+ + OH^- \to Fe(OH)_3 \downarrow
\]
Một Số Tính Chất Khác Của Fe(OH)₂
Cấu Trúc Phân Tử và Liên Kết
Fe(OH)₂ là một hợp chất ion nhưng có thể thể hiện tính chất kết hợp ion - cộng hóa trị:
- Fe²⁺ có cấu hình electron: [Ar] 3d⁶.
- Trong môi trường rắn hoặc tinh thể, các ion OH⁻ phối trí xung quanh ion Fe²⁺, tạo thành mạng tinh thể với liên kết Fe-O.
Tính Khử Và Khả Năng Tham Gia Phương Trình Oxy Hóa - Khử
Fe(OH)₂ là tác nhân khử nội sinh, có khả năng truyền electron cho các chất oxy hóa mạnh hơn.
Làm Sao Để Kết Tinh Fe(OH)₂ Để Không Bị Oxy Hóa
Việc cô cạn và kết tinh Fe(OH)₂ là một thách thức lớn trong thực hành hóa học vì Fe(OH)₂ rất dễ bị oxy hóa bởi O₂ không khí. Để điều chế và bảo quản Fe(OH)₂ trong trạng thái tinh khiết, cần tuân thủ các nguyên tắc sau:
Nguyên Tắc Cần Tuân Thủ
- Tuyệt đối tránh O₂ không khí: Cần tiến hành quy trình trong môi trường trơ (N₂ hoặc Ar).
- Sử dụng nước khử khí: Nước cất cần được đun sôi trước và làm nguội.
- Duy trì môi trường khử yếu: Dùng chất khử nhẹ để ổn định Fe²⁺.
Bảo Quản
- Không tiếp xúc với không khí.
- Bảo quản mẫu Fe(OH)₂ trong bình kín chứa khí trơ.
Kết Luận và Ứng Dụng
Phản ứng từ Fe(OH)₂ ra Fe(OH)₃ không chỉ là một quy trình hóa học thú vị mà còn có nhiều ứng dụng thực tiễn trong ngành xử lý nước, giảng dạy hóa học cũng như mô phỏng quá trình ăn mòn. Thông qua việc hiểu rõ về nguyên lý phản ứng, điều kiện và tính chất của các chất tham gia, người đọc có thể áp dụng kiến thức này trong nhiều lĩnh vực nghiên cứu và chuyên môn khác nhau.
Trong cuộc sống hàng ngày, việc hiểu biết về các phản ứng như thế này không chỉ góp phần giúp chúng ta biết cách xử lý nước thải một cách hiệu quả mà còn cung cấp kiến thức cơ bản cho việc giảng dạy và học tập hóa học.


















![Tổng Hợp 101+ Hình Nền iPhone Cute, Dễ Thương [Cập Nhật Liên Tục]](/uploads/blog/2025/10/28/b07828a9e2c24d9489f58c76200642142b7e613c-1761600265.webp)
